

| Es gibt eine Vielzahl von Farbstoffen, die unter gewissen Umständen ihre Farbe ändern. Das ist nichts Neues, und jeder kennt im Laufe der Zeit sich verändernde Farben: Nasses ist dunkler als Trockenes, beim Umhängen von Bildern bleiben die Umrisse der Rahmen auf der Tapete sichtbar, nach der hundertsten Wäsche ist das T-Shirt irgendwie anders, die weißen Nachbarn kommen braun dem Urlaub zurück, der lebendig ins kochende Wasser geworfene Hummer wird rot... | In dieser Abteilung soll von ungewöhnlicheren Farbstoffen die Schreibe sein. Farbstoffe, wie sie nicht in jedem Kaufhaus zu erwerben sind und deshalb irgendwie "besonders" sind. Sie werden u. a. für modischen Schnickschnack verwendet oder für Dokumente, bei denen Kopiermaschinen versagen. Es sind oft Substanzgemische die sichtbar und reversibel ihre Farbe ändern und bestehen manchmal aus einem chemischen Cocktail, der z. T. in Mikrokapseln eingeschlossen ist. Die Farbänderung kann umkehrbar sein und z. B. in Messinstrumenten Verwendung finden. Oder auch nicht, und dann sind diese Farbstoffe z. B. gut für die Anzeige von Manipulationen an Dokumenten. |
Ein wenig genauer wird hier auf die folgenden Farbstoffe eingegangen:
|
| Zum Nachweis von Wasser eignet sich Kobaltchlorid, welches auch in einigen Geheimtinten zu finden ist. In wässrige Kobaltchloridlösung getauchte und dann getrocknete Papierstreifen sind blau, um bei Anwesenheit von Wasser in rot umzuschlagen. Dekorativer und nützlicher sind Wetteranzeiger (Wetterblumen, Barometerblumen, Wetterbilder). Je nach Luftfeuchte ändert sich deren Farbe von rot (große Feuchtigkeit) über rosenrot (Regen), blaurot (trockene Witterung) nach lavendelblau (sehr trockene Witterung). Mit der folgenden Lösung lassen sich ungefärbte Stoffblumen oder Papierbilder zu einer Wetterstation umfunktionieren. Man nehme:
Die getrocknete Lösung enthält blaues Kobalt(II)-tetrachlorocobaltat(II), welches mit Wasser den rosafarbenen Hexaquocobalt(II)-chlorid-Komplex bildet: Co[CoCl4] + 12 H2O à 2 [Co(H2O)6]Cl2. |
Photochrome Farbstoffe wechseln - mehr oder minder schnell - von durchsichtig zu "farbig" durch die Einwirkung von UV-Licht (Sonnenlicht, Schwarzlichtlampen) und sind seit den frühen 1990ern bekannt. In der guten Stube sehen z. B. Aufdrucke auf T-Shirts anders aus als draußen im Freien:  Speziell für die Damen ist photochromer Nagellack zu empfehlen. |
 |
KaufMich |
Allerlei Schnickschnack: http://www.solaractiveintl.com/page2.htm |
| UV-Licht verändert die chemische Struktur der Farbstoffe und damit ihr Absorbtionsverhalten. Anders als bei den gewöhnlichen Pigmenten, die einen Teil des Lichtes reflektieren, absorbieren photochrome Farbstoffe einen Teil des Lichtes und lassen den Rest durch. Vor einem schwarzen Hintergrund ist also kein Effekt zu bemerken. Am besten ist ein möglichst heller, weißer Hintergrund, der die verbleibenden Lichtanteile reflektiert und damit "farbig" wird. Ein photochromer Farbstoff kann auch auf einem schwarzen Hintergrund seine Farbe wechseln, wenn er mit einem Pigment-Farbstoff gemischt wird. |
Leider sind photochrome Farbstoffe auf Dauer instabil, sie ändern ihre chemische Struktur im Laufe der Zeit. Je länger sie UV-Licht ausgesetzt sind, um so weniger kehren sie in den durchsichtigen Zustand zurück. Nach ein paar Monaten im Sonnenschein verlieren sie ihre Eigenschaft, im Schrank dagegen halten sie jahrelang. Es gibt anorganische und organische photochrome Farbstoffe. Zu den anorganischen gehören die Silber-Halogenide, auf oder in Gläsern für Sonnenbrillen zu finden. Im Glas eingelagerte und fein verteilte Silberhalogen-Kriställchen (10-20 nm) sorgen für das wechselnde Absorbtionsverhalten der Brille bei Sonnenschein oder bewölktem Himmel. Die dem Silber anhaftende Farbe Grau (jeder Schwarzweißfotograf mit Dunkelkammer kennt dies) kann zu freundlicherem Braun durch Beigaben von Gold oder Palladium verändert werden. |
Gut bekannt sind Substanzen, deren Farbänderung bei einer Temperaturerhöhung ihre Kristallstruktur und somit ihre Farbe ändern:
|
| 1838 | Schönbein | Ueber die Ursache der Farbenveränderung, welche manche Körper unter dem Einflusse der Wärme erleiden | Annalen der Physik und Chemie 121 (2-45) | 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 |
| Energiespeicherung durch chemische Systeme | http://www.axel-schunk.de/experiment/edm0398.html |
Es gibt tausende von diesen organischen thermochromen "Farbstoffen", chemische Cocktails mit temperaturabhängigen Gleichgewichtszuständen. Um sie zusammenzuhalten und "gefahrlos" in unserer Umwelt als Farbstoff verwenden zu können, werden davon winzige Tröpfchen in Mikrokapseln eingeschlossen und können in entsprechenden "Lösungs"-Mitteln wie eine normale Farbe verwendet werden. Die Mikrokapseln sind zwar recht klein (3-5 microns), aber die kleinsten sind immer noch 10 Mal größer als normale Pigmente. Werden sie undicht, können sie allerlei Schwierigkeiten machen. Die Haltbarkeit liegt im Jahresbereich, bei Zimmertemperatur und im Dunkeln. Im kühlen Zustand zeigen sie Farbe, um bei Erwärmung durchsichtig zu werden. Mischt man sie mit normalen Pigment-Farbstoffen, sind die schönsten Farbübergänge machbar. Soll z. B. auf einer Tasse beim Eingießen heißer Flüssigkeit ein Bild erscheinen, druckt man über das Bild eine Schicht thermochromen Farbstoff. Soll es verschwinden, muss das Bild komplett aus entsprechenden thermochromen Farbstoffen bestehen. Mischt man beide Techniken, sind die schönsten Effekte erreichbar. |
| Auf Kaffee-/Tee-Tassen oder -Pötten. |  |
| Auf Maus-Pads oder "magischem" Papier: Motive erscheinen und verschwinden durch die Handwärme. | 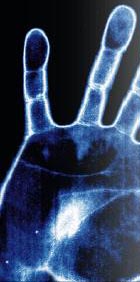 |
| Auf Verpackungen: es ist klar sichtbar, ob ist das Bier kühl genug oder die Mikrowellensuppe servierbar ist. |  |
| Als Zeichenstifte zur Temperaturbestimmung und in Form von Temperaturlacken. | 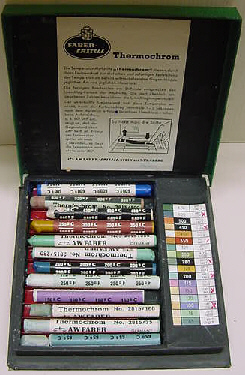 |
...oder:
|
| Bierwerbung, die beim Pinkeln (sorry) erscheint, oder eine Frau, deren Bekleidung wegepinkelt (doppel-sorry) werden kann ... | http://www.halfbakery.com/idea/urinals | |
| ... und, wo ich schon beim Thema bin, ... (noch mehr sorry) | http://www.wasser-wissen.de/uebersichten/skurriles.htm#Showdown |
 |
Letzte Änderung 25.6.2005 |